研究テーマ
血管を健全に保つための研究
血管が破裂する病気 -腹部大動脈瘤-
AAA病態を理解し、予防・治療法を確立する
腹部大動脈瘤(AAA)は、腹部大動脈の進行的な拡張を主病変とする疾患です。血管拡張とともに破裂の危険性が増します。自覚症状なく進展するため、突然死の原因となることも多いです。現在、食事による予防法や治療薬は存在せず、拡張や破裂の原因もよくわかっていません。本プロジェクトでは、不明点の多いAAA病態を理解し、予防・治療法を確立することを目指しています。
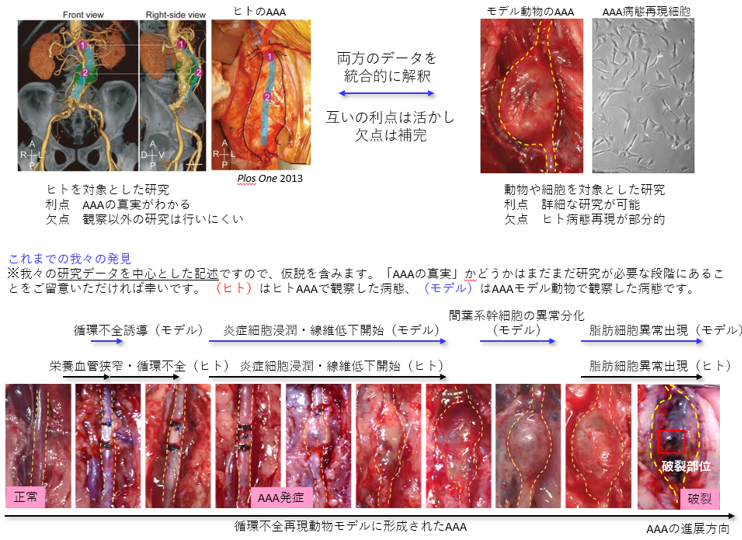
血管がなぜ弱くなっていく?なぜ瘤ができる?-我々の発見と仮説-
血管壁内の細胞が正常に働くためには、血液に含まれる酸素や栄養素が十分に血管壁に供給される必要があります。血管は絶えず血液に触れているため、酸素や栄養素を確保するのは簡単と思いきや、大動脈は3層(内膜・中膜・外膜)の厚い構造となっているので、内側からの血流の拡散だけでは中膜・外膜まで届きません。そこで、中外膜への酸素や栄養素の供給の役割を担うのが「栄養血管」と呼ばれる血管壁内に存在する毛細血管です。これまでの研究で、AAA患者さんの栄養血管の通り道が非常に狭くなって(狭窄して)おり、血管全体にうまく酸素や栄養素を供給できていない状態(血流循環がおかしくなっているため、「循環不全」と我々は呼んでいます)になっていることを発見しました(発表論文1)。その後の研究で、この栄養血管の狭窄が、血管の正常な構造と機能の維持に重要な線維成分(膠原線維と弾性線維)を低下させることでAAA形成の原因となりうることを報告しました(発表論文2)。
栄養血管の構造と機能を維持することがAAA発症・進展の予防に重要であると我々は考えています。
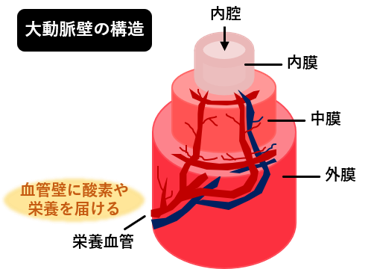
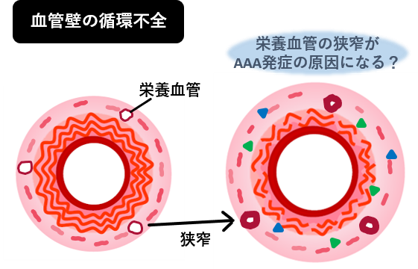
▲血管の中にも血管がある ▲栄養血管の狭窄がAAA発症の一因となる
血管はなぜ破裂する?-我々の発見と仮説-
AAAは破裂すると死亡リスクが極めて高いため、破裂の予防が重要です。高血圧などは破裂の危険性を高める要因であることがわかっていますが、それがすべてであるとも考えられていません。そこで我々は、血管破裂に至るメカニズムを明らかにするための研究を行い、血管壁に異常出現する脂肪細胞がAAA破裂の原因の一つである可能性を報告しました(発表論文3)。脂肪細胞は本来血管壁にはほとんど存在しませんが、AAAを発症した血管壁では「脂肪化」が生じていました。元々血管壁を構成する膠原線維や線維芽細胞などが存在していた場所に、そこに存在するべきでない脂肪細胞が異常に増えてくると、血管の統合性が破綻します。また、肥大化した脂肪細胞やそれにより呼び寄せられた免疫細胞は、線維を破壊する作用のある因子(マトリックスメタロプロテアーゼ)を分泌することで、脂肪細胞周辺の線維成分を低下させる原因にもなります。脂肪細胞を中心として動脈壁の破壊が進むため、脂肪細胞の占める面積が増加するにつれてAAA破裂リスクが上昇していくと推測されます(発表論文4)。血管が脂肪化するメカニズムについては次項に詳しく説明しています。
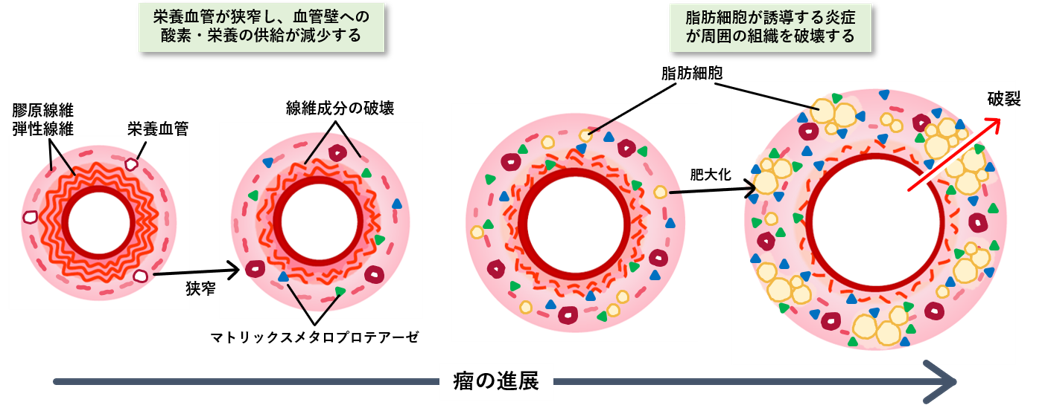
▲腹部大動脈瘤の推測される進展メカニズム
血管の脂肪化が血管破裂の原因となる
健全な血管の機能の維持には、様々な形と機能を持つ細胞どうしが協調して働くことが重要です。病気にかかってしまった血管では、細胞どうしがうまく協調できなくなります。協調がうまくいかなくなる原因は様々存在しますが、我々はこれまでに、「血管が脂肪化する」ことが大動脈瘤破裂の一因であることを発見しました。
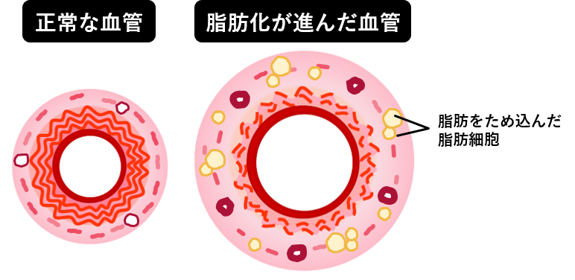
▲ヒトAAA組織で観察される血管の脂肪化(発表論文5)
「血管が脂肪化する」を細胞レベルの話で言い換えると、「血管に脂肪をため込む脂肪細胞が多数出現する」ということになります。本来、血管の中には脂肪細胞はほとんど存在しません。我々はなぜAAA患者さんの血管が脂肪化していくのかに興味を持ちました。 細胞の中には体内を自由に動き回れるものも存在しますが、脂肪細胞は一度生まれるとその場から動くことができない細胞です。つまり、血管に現れた脂肪細胞はどこかからやってわけではなく、その場で生まれた可能性が高いと考えられます。一体なぜ、血管で脂肪細胞が生まれてるのでしょうか?
我々は間葉系幹細胞(MSC)がこの現象に関わっていると考えています。聞きなれない名前の細胞だと思いますが、 MSCは色々な細胞に変化(専門用語では分化)する能力を持っている細胞です。普段はこの能力を活かして、血管で必要とされている細胞に分化し、正常な血管の構造や機能の維持を支えています。血管に何が必要とされているのかを血管の中の環境から察する能力がMSCにはあるのですが、大動脈瘤になってしまった血管は、通常の血管とは異なる異常な環境下にあります。この異常な環境下で、「必要とされているのは脂肪細胞だ」と勘違いしてしまうことが血管の脂肪細胞化の原因である可能性を我々は発見しました。ここでは簡単に説明しておりますので、もう少し詳しい内容は応用細胞生物学研究室のHP(https://www.nara.kindai.ac.jp/laboratory/cell-biology/aaa.html)、さらに詳しい内容に興味を持っていただける方は原著論文をご覧ください(発表論文6) 。MSCは血管の中にもともと存在していますが、大動脈瘤において血管の脂肪化をもたらすMSCの一部はPVATからも来ているようです。
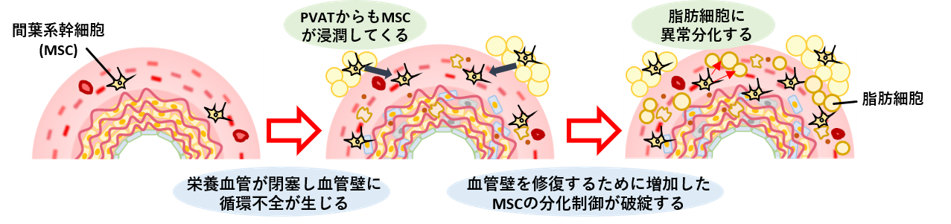
▲推測されるAAA壁におけるMSCの分化異常と脂肪化メカニズム
AAA発症・進展に至るまでの病態変化を理解する
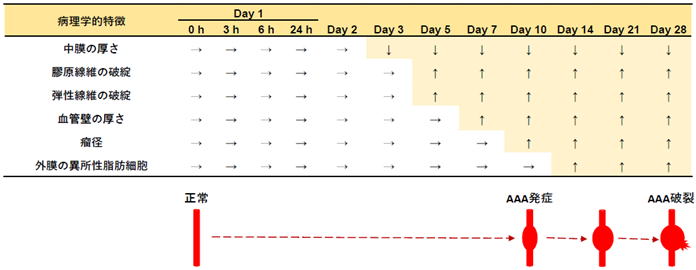
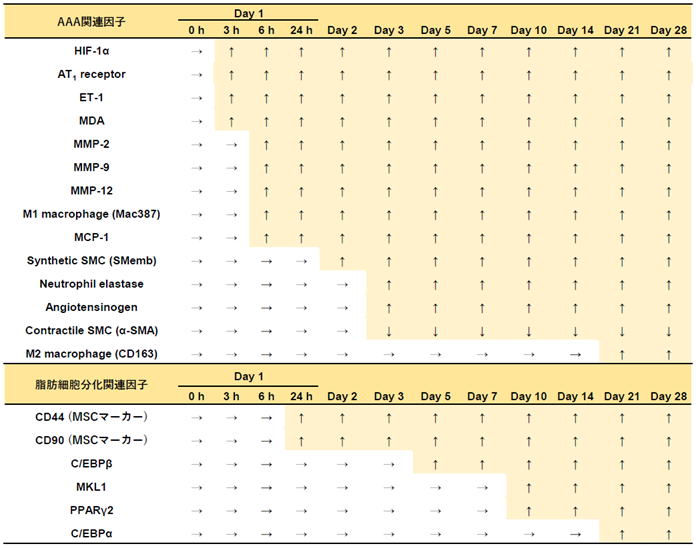
AAAが見つかってから破裂を予防することは重要ですが、AAA発症を予防することも重要です。そのためには、AAA発症リスクが増加してから瘤が形成されるまでにどういう病態変化が起きているかを理解する必要があります。そこで我々は、AAA発症に起因する血管壁の循環不全が生じてから経時的に病理観察を行いました(発表論文7)。その結果を表にまとめました。瘤径が増加した時点(Day 10)をAAA発症として、それより前をAAA発症までの病態変化、それ以降をAAA進展中の病態変化として理解することができます。これにより、AAA関連因子の中でもごく初期から変動するものや後期に変動するものがあることが明らかになりました。ごく初期のAAA因子の変動を防ぐことでAAA発症の予防が可能になるかもしれません。
<循環不全誘導AAAの発症・進展に至るまでの病態変化>
<循環不全誘導AAAの発症・進展に至るまでのAAA関連因子の発現変動>
食事として摂取したEPAは血管のどこにいる?
魚の油などに特徴的に含まれるEPA(エイコサペンタエン酸)は、心血管疾患の予防に効果的であることが多くの研究で報告されています。なぜEPAに心血管疾患予防効果があるのかを明らかにするための研究はこれまでに数多く行われ、EPAから作られる物質(エイコサノイドと呼ばれます)には、行き過ぎた免疫応答を抑制する効果があり、それによって血管保護効果が発揮されているということがわかってきました。このようなEPAの生理活性に関する研究は現在も世界中で行われ、今もなお新たな発見が相次いでいます。このような状況のもと、本研究開始のきっかけとなった疑問は「そもそもEPAは血管のどこにいるのだろうか」というものでした。「EPAが血管に存在し、異常状態となった血管を保護する働きをしている」ことは多くの研究で明らかになっている一方で、「EPAは血管のどこにいる?」に対する疑問に答えられる研究は存在しませんでした。
この疑問に答えるために、質量分析イメージング法と呼ばれる方法を用いて血管に存在するEPA含有リン脂質(EPA-PC)の可視化を試みました(EPAは体内ではEPA単独で存在するというより、リン脂質と結合して存在することが一般的であるため、本研究ではリン脂質に結合したEPAを対象としました)。その結果、EP-PCは血管にまんべんなく存在するのではなく、たくさん集まっている場所とそうでない場所があることがわかりました。なぜこのような偏りが生じるのかを調べた結果、EPA-PCはM2マクロファージと呼ばれる細胞の分布とよく似た分布を取る一方で、M1マクロファージと呼ばれる細胞の分布とは一致しないということがわかりました。この結果は、EPAがM2マクロファージの構成成分として取り込まれていることを示唆する結果です。M1マクロファージもM2マクロファージも免疫細胞の一種ではありますが、働きが異なっています。異物に対して、攻撃的に働くのはM1マクロファージです。M2マクロファージは免疫応答を終了させたり、破壊された組織を修復する働きをします。それぞれの細胞の働きと本研究の結果を合わせて考えると、行き過ぎた免疫応答を調節する働きのあるEPAを必要とするM2マクロファージがEPAを積極的に取り込む一方で、M1マクロファージはEPAをそれほど取り込まないという選択性があることが推測されます(発表論文8、9)。
発表論文
1 栄養血管の狭窄によりAAA患者の血管壁で循環不全が生じている可能性を示した論文
Adventitial vasa vasorum arteriosclerosis in abdominal aortic aneurysm. Tanaka H, Zaima N, Sasaki T, Hayasaka T, Goto-Inoue N, Onoue K, Ikegami K, Morita Y, Yamamoto N, Mano Y, Sano M, Saito T, Sato K, Konno H, Setou M, Unno N. Plos One. 2013 Feb 27;8(2):e57398. doi: 10.1371/journal.pone.0057398.
2 血管内の循環不全がAAA形成の原因となりうることを証明した論文
Hypoperfusion of the adventitial vasa vasorum develops an abdominal aortic aneurysm. Tanaka H, Zaima N, Sasaki T, Sano M, Yamamoto N, Saito T, Inuzuka K, Hayasaka T, Goto-Inoue N, Sugiura Y, Sato K, Kugo H, Moriyama T, Konno H, Setou M, Unno N. Plos One. 2015 Aug 26;10(8):e0134386. doi: 10.1371/journal.pone.0134386.
※最初の発見から世に出るまで紆余曲折で7年かかりました。2015年にPlos Oneに掲載された論文の被引用数のトップ10%に入りました。
3 血管壁内の脂肪細胞の出現がAAA破裂の原因となりうることを報告した論文
Adipocyte in vascular wall can induce the rupture of abdominal aortic aneurysm. Kugo H, Zaima N, Tanaka H, Mouri Y, Yanagimoto K, Hayamizu K, Hashimoto K, Sasaki T, Sano M, Yata T, Urano T, Setou M, Unno N, Moriyama T. Sci Rep. 2016 Aug 8;6:31268. doi: 10.1038/srep31268.
※シュプリンガーネイチャーの編集部が選ぶ「おすすめのコンテンツ」として取り上げられました。
(http://www.natureasia.com/ja-jp/srep/abstracts/79960)
4 AAA破裂に沿うように脂肪細胞が出現する病理像の撮影に成功した論文 AAA破裂における脂肪細胞の関与仮説を提唱
Pathological analysis of the ruptured vascular wall of hypoperfusion-induced abdominal aortic aneurysm animal model. Kugo H, Zaima N, Tanaka H, Hashimoto K, Miyamoto C, Sawaragi A, Urano T, Unno N, Moriyama T. J Oleo Sci. 2017 May 1;66(5)499-506. doi: 10.5650/jos.ess16219.
※ J.Oleo Sci. Impact Award(同年に発表された論文のうち、引用数が最も多かった論文に与えられる賞)を受賞しました。
5 AAA患者の血管壁に脂肪細胞が異常出現していることを発見した論文
Imaging mass spectrometry reveals a unique distribution of triglycerides in abdominal aortic aneurysmal wall. Tanaka H, Zaima N, Sasaki T, Yamamoto N, Inuzuka K, Sano M, Saito T, Hayasaka T, Goto-Inoue N, Sato K, Kugo H, Moriyama T, Konno H, Setou M, Unno N. J Vasc Res. 2015 Sep 9;52(2):127-135. doi: 10.1159/000439169.
※ヒトAAA壁における脂肪細胞出現の重要性を初めて指摘した論文です。
6 AAA壁に異常出現する脂肪細胞の由来の一部は血管周囲脂肪組織に存在する間葉系幹細胞であることを証明した論文
The role of perivascular adipose tissue in the appearance of ectopic adipocytes in the abdominal aortic aneurysmal wall. Kugo H, Moriyama T, Zaima N. Adipocyte. 2019 Dec 8;8(1):229-239. doi: 10.1080/21623945.
7 循環不全が誘導するAAAの発症および進展に至るまでの病態変化を示した論文
Time-Dependent Pathological Changes in Hypoperfusion-Induced Abdominal Aortic Aneurysm. Kugo H, Sukketsiri W, Tanaka H, Fujishima R, Moriyama T, Zaima N. Biology. 2021 Feb 14;10(2):149. doi: 10.3390/biology10020149.
8 モデル動物に形成される腹部大動脈瘤壁のEPA分布を解析した論文
Fujishima, R., Kugo, H., Yanagimoto, K.,
Enomoto, H., Moriyama, T., Zaima, N: Similar distribution of orally
administrated eicosapentaenoic acid and M2 macrophage marker in the aortic wall
of hypoperfusion-induced abdominal aortic aneurysm. Food. Funct. 12, 3469-3475, 2021.
Kugo, H., Tanaka, H., Moriyama, T., Zaima, N: Characteristic distribution of eicosapentaenoic acid in human abdominal aortic aneurysm wall. J. Lipid Res.. In press.