腹部大動脈瘤の予防・治療法の確立に向けて
腹部大動脈瘤とは
腹部大動脈瘤(Abdominal aortic aneurysm: AAA)は腹部の大動脈の進行的な拡張を主病変とする疾患です。AAAの拡張は無自覚、無症状であることが多く、拡張するにつれてAAA破裂の危険性が増加します。無自覚、無症状のままAAAが突然破裂するため、サイレントキラーと呼ばれることもあります。米国では毎年約20万人がAAAと診断され、55歳以上男性死因の15位(米国)、10位(英国)と報告されています。男性患者数が多いことから、65歳以上の男性に対するスクリーニングを行っている国も多く存在します。日本における正確なAAA患者数は不明ですが、「大動脈瘤及び解離(AAA以外の大動脈瘤や動脈解離を含む)」は全死因の9位に位置しています(平成27年度 厚生労働省 人口動態統計)。現在は、破裂を防ぐ方法として人工血管置換術やステントグラフト内挿術といった外科的治療法しかありません。
AAAの薬物療法や予防法は確立されていないのが現状であり、これらの確立が強く望まれています。
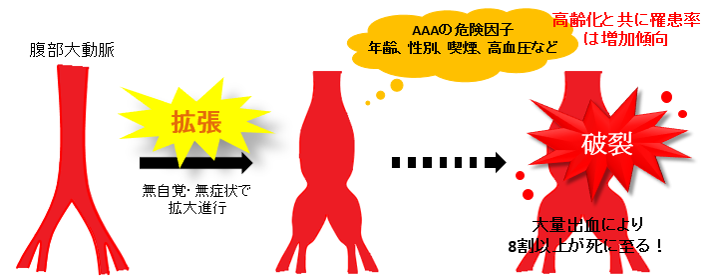
腹部大動脈瘤はなぜ発症するのか
血管の拡張には血管壁の脆弱化が関与していると考えられていますが、AAA発症や血管の拡張に至る機構は完全には明らかになっていません。AAA組織では、様々な病態が不均一に存在しており、おそらくAAA発症に至る原因は一つではないと推測されます。
我々はこれまでに、質量分析イメージング(MSI)(MSIに関しては、可視化技術の応用開発 をご覧ください)によるヒトAAAの病理解析の結果をもとに、腹部大動脈壁の循環不全がAAA形成の一因となりうることを見出しました(Tanaka
and Zaima et al. PLoS One 2013、Tanaka and Zaima et al. PLoS One 2015)。動脈壁も生きている細胞で構成されているため、酸素や栄養素を供給される必要がありますが、動脈内の毛細血管(栄養血管)が狭窄し、血流停滞(循環不全)が生じると、酸素や栄養素が十分に供給されなくなります。これにより、動脈壁内の細胞が弱ることが、AAA形成に至る血管の脆弱化の一因ではないかと「推測」されます。
腹部大動脈瘤はなぜ破裂するのか
AAA発症機構と同様に、AAAが破裂する原因も完全には明らかになっていません。血管径を正常に保つ役割を担う血管線維(弾性線維・膠原線維)の質が低下することによる動脈壁の脆弱化が破裂の素因であることはほぼ間違いないと考えられます。しかしながら、小さなAAAが破裂することも多く、線維成分以外にも破裂に関与する因子がある可能性が考えられます。
我々は、動脈壁に人工的に循環不全を誘導したAAAモデル(循環不全誘導型AAAモデル)を用いて、動脈壁に異常出現する脂肪細胞がAAA破裂の主要な原因の一つであることを明らかにしました(Kugo,
Zaima, and Tanaka et al. Sci. Rep. 2016)。このモデルに中性脂肪の一種であるトリオレインを投与すると血管壁の脂肪細胞の成長が促進され、AAA破裂リスクが上昇した一方で、EPAを高含有する魚油を投与すると動脈壁の脂肪細胞の成長が抑制され、AAAが破裂しにくくなることを見出しました。動脈壁で肥大化した脂肪細胞の周りでは、MCP-1(免疫細胞を呼び寄せる効果などがある因子)が多く分泌されており、これが脂肪細胞周囲にマクロファージなどの免疫細胞を呼び寄せていることを見出しました。呼び寄せられた細胞が、マトリックスメタロプロテアーゼ(血管の強度を保っている線維を破壊する作用がある因子)を分泌することにより、脂肪細胞周辺の線維成分を低下させる原因となることも明らかにしました。肥大化した脂肪細胞を中心にして動脈壁の破壊が進むため、動脈壁に脂肪細胞が増加するにつれて破裂のリスクが上昇していくと考えられます。AAAモデルで観察された病理像はヒトAAA病理像ともよく一致しており、脂肪細胞はヒトAAA破裂を予防するための重要な標的細胞になると考えています。近年、ヒトAAA組織を解析した海外の研究グループからも脂肪細胞の病理学的重要性を報告する論文が複数報告されており、今のところ、我々の仮説とヒトで観察される病態は矛盾していません。
血管壁の脂肪細胞がAAA破裂の主要な原因の一つであることを明らかにした論文「Adipocyte in vascular wall can induce the rupture of abdominal aortic aneurysm」(Kugo, Zaima, and Tanaka et al. Sci. Rep. 2016)は、シュプリンガーネイチャーの編集部が選ぶ「おすすめのコンテンツ」として取り上げられました。 http://www.natureasia.com/ja-jp/srep/abstracts/79960
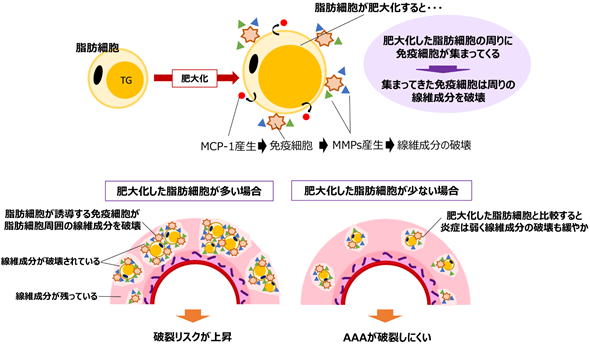
▲血管壁に異常出現する脂肪細胞と破裂の関係
循環不全誘導AAAモデルの特徴と発症から破裂に至るまでの病理変化
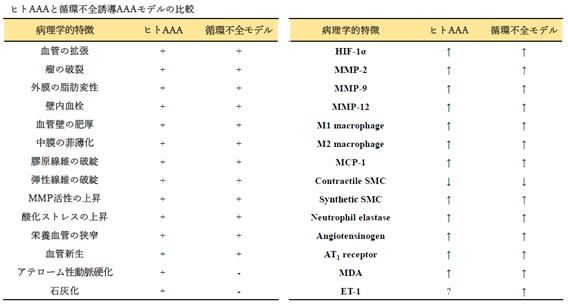
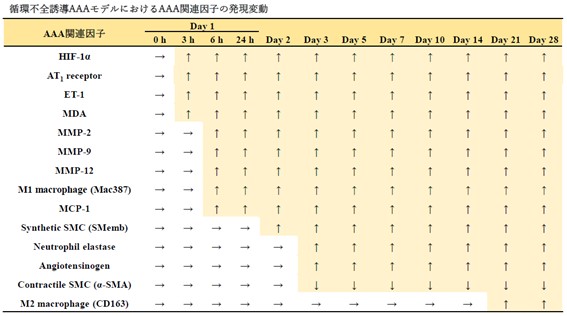
我々のAAA研究では、主に循環不全誘導AAAモデルを用いています。AAA病態解明や予防・治療法の確立のために、使用している病態モデルがどの程度ヒトの疾患の特徴を再構成しているのか、発症から破裂に至るまでどのように進行するのかを明らかにすることは重要です。そこで我々は、循環不全誘導処置後に経時的に大動脈壁の病理を観察し、ヒトAAA病理との比較を行いました(Kugo et al. Biology. 2021)。
血管壁の血流を遮断し循環不全を引き起こした瘤壁では、ヒトAAAで特徴的な瘤の拡張・破裂や中膜の破綻、慢性炎症、壁在血栓、外膜の異常な脂肪変性などが観察されます。血管壁の脂肪細胞出現を伴った瘤破裂を再現できるAAAモデルは本モデルのみですが、そのほかにもヒトAAAで観察される多くの病理学的特徴を再構成していることが確認されました。
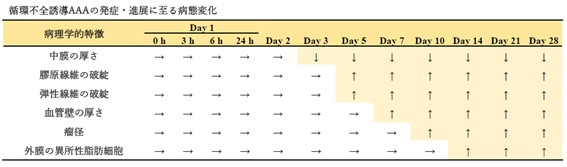
また、AAA発症に至るまでにどのような病理変化が生じるのかを理解するために、循環不全を誘導してから経時的に病理像を観察しました(解析した写真は1万枚を超えました)。その結果を表にまとめました。これにより、AAA関連因子の中でもごく初期から変動するものや後期に変動するものがあることが明らかになり、AAA進展過程で、「いつ」「何が」起こるかが明確になってきました。
動脈壁の脂肪細胞はいったいどこから来たのか
動脈壁には本来ほとんど脂肪細胞は存在しませんが、AAAを発症すると脂肪細胞が動脈壁外膜に異常出現してきます。脂肪細胞そのものは動くことができないので、脂肪細胞はいったいどこからどのようにして生じるのでしょうか? 最近、我々はAAA壁における脂肪細胞の出現に、血管周囲脂肪組織(PVAT)と間葉系幹細胞(MSC)が関連する可能性を報告しました(Kugo et al. Adipocyte. 2019)。大動脈壁内には、血管平滑筋細胞や脂肪細胞、骨芽細胞などへの多分化能をもったMSCが存在しています。循環不全誘導AAAモデルにおいて、動脈壁内でMSC(CD44、CD90、CD105陽性、CD45陰性)の増加が観察され、この細胞において、脂肪細胞分化に関与する因子であるPPARγ2やC/EBPsなどが発現していました。MSCはPVATにも存在しており、PVATをある程度除去してから循環不全誘導処置を行うと、動脈壁内のMSCおよび脂肪細胞数が減少しました。これらの結果から、PVATがAAA壁内で増加したMSCの由来の一つであると考えられます。MSCは血管壁内では通常血管平滑筋細胞などに分化して、血管壁の安定性に寄与していると考えらえています。動脈壁を修復するためにPVATから間葉系幹細胞が浸潤してくると考えられますが、循環不全による低酸素・低栄養状態といった異常な環境が起因して、MSCの分化制御が破綻して脂肪細胞に異所的に分化する可能性があると推測されます。血管壁内のMSCの分化を適切に制御することは、AAA進展・破裂予防に効果的であるかもしれません。
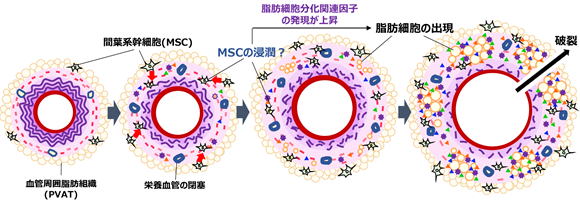
▲血管周囲脂肪組織における間葉系幹細胞および脂肪細胞出現の関係

血管壁の脆弱化とニコチン、たばこの副流煙から身を守る
喫煙は、AAA進展・破裂リスクを上昇させる要因です。近年の研究で、たばこの成分であるニコチンがAAA進展に関与していることが報告されました(Wang
et al. Nat. Med. 2012など)。本研究室においても、ニコチンが、大動脈血管壁においてマトリックスメタロプロテアーゼの活性化、弾性線維・膠原線維破壊を誘導することを示しました(Kugo
et al. Biotech. & Histochem. 2017)。 喫煙者はまず禁煙をすることが第一選択肢となりますが、家庭内に喫煙者がいる方や飲食店経営などたばこと日常的に接することから逃れられない方々は副流煙によってAAA発症の危険性が上がってしまう可能性があります。我々はこの問題に対し、食品成分によって少しでもニコチンによる血管損傷を抑制できないかと考え、この研究に取り組み始めました。これまでに、EPA高含有魚油やDNA高含有サケ白子抽出物、ゴマ抽出物(セサミン・セサモリン高含有)、大豆イソフラボン、黒大豆種皮アントシアニジンに、血管壁の線維成分の破壊抑制効果があることを示しました(Kugo
et al. Food & Funct. 2017; Hashimoto et al. J. Nutr. Sci. Vitaminol. 2018; Kugo et al. J. Oleo Sci. 2019; Wanida et al. J. Oleo. Sci. Hoshino et al. J. Nutr. Sci. Vitaminol.)。これらの血管壁保護作用が期待される食品成分の摂取は、ニコチンの作用を減弱化させることによって、AAA形成促進を抑制することにつながる可能性があります。食品はバランスよく摂取することが重要であるため、上記物質のどれをか集中的にとるのではなく、バランスが保たれた中で機能性成分を摂取する意識が大事だと考えられます。今後は、上記以外にも様々な成分を発見したいと考えています。
AAA患者は男性が女性の4倍、でも、女性のAAAは男性の4倍速く成長する なぜ?
AAA患者は男性の方が多いため、基礎研究は圧倒的に男性に焦点を当てたものが多いです。たしかに女性は(相対的に)患者数が少ないのですが、一度発症すると、その進展速度は男性の4倍速く、破裂の危険性も高いことが知られています。
我々はAAA進展に性差が生じる理由に、女性の卵巣機能の低下があることを発見しました(Miyamoto and Kugo et al. Sci. Rep. 2019)。卵巣を除去したメスの循環不全誘導型AAAモデルは、AAA発症率が上昇し、形成されるAAAの大きさも大きくなりました。卵巣の除去により、血管の線維を破壊するMMPが増加し、線維成分が破壊され、AAA発症前から血管強度が低下してしまうことがその原因であると考えられます。この現象は女性に特有の現象であり、女性患者のAAAの予防・治療法には男性とは別の戦略を立てる必要があるかもしれません。この方法については現在、研究中です。
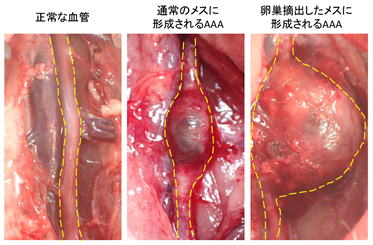
▲卵巣摘出した動物に形成されるAAA
食事として摂取したEPAは血管のどこにいる?
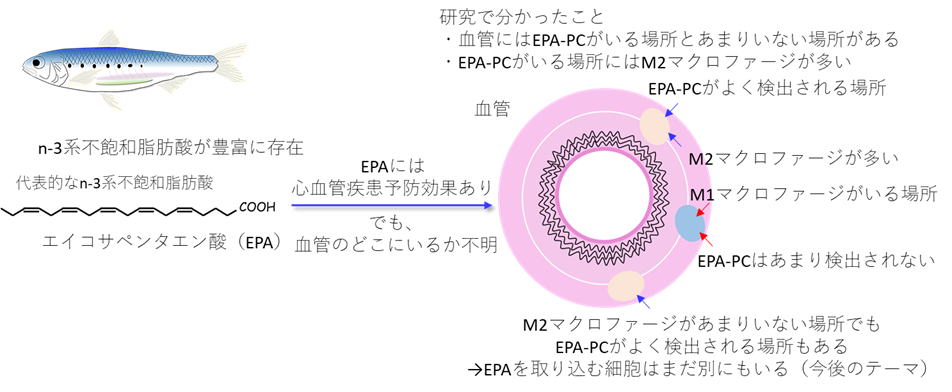
魚の油などに特徴的に含まれるEPA(エイコサペンタエン酸)は、心血管疾患の予防に効果的であることが多くの研究で報告されています。なぜEPAに心血管疾患予防効果があるのかを明らかにするための研究はこれまでに数多く行われ、EPAから作られる物質(エイコサノイドと呼ばれます)には、行き過ぎた免疫応答を抑制する効果があり、それによって血管保護効果が発揮されているということがわかってきました。このようなEPAの生理活性に関する研究は現在も世界中で行われ、今もなお新たな発見が相次いでいます。このような状況のもと、本研究開始のきっかけとなった疑問は「そもそもEPAは血管のどこにいるのだろうか」というものでした。「EPAが血管に存在し、異常状態となった血管を保護する働きをしている」ことは多くの研究で明らかになっている一方で、「EPAは血管のどこにいる?」に対する疑問に答えられる研究は存在しませんでした。
この疑問に答えるために、質量分析イメージング法と呼ばれる方法を用いて血管に存在するEPA含有リン脂質(EPA-PC)の可視化を試みました(EPAは体内ではEPA単独で存在するというより、リン脂質と結合して存在することが一般的であるため、本研究ではリン脂質に結合したEPAを対象としました)。その結果、EP-PCは血管にまんべんなく存在するのではなく、たくさん集まっている場所とそうでない場所があることがわかりました。なぜこのような偏りが生じるのかを調べた結果、EPA-PCはM2マクロファージと呼ばれる細胞の分布とよく似た分布を取る一方で、M1マクロファージと呼ばれる細胞の分布とは一致しないということがわかりました。この結果は、EPAがM2マクロファージの構成成分として取り込まれていることを示唆する結果です。M1マクロファージもM2マクロファージも免疫細胞の一種ではありますが、働きが異なっています。異物に対して、攻撃的に働くのはM1マクロファージです。M2マクロファージは免疫応答を終了させたり、破壊された組織を修復する働きをします。それぞれの細胞の働きと本研究の結果を合わせて考えると、行き過ぎた免疫応答を調節する働きのあるEPAを必要とするM2マクロファージがEPAを積極的に取り込む一方で、M1マクロファージはEPAをそれほど取り込まないという選択性があることが推測されます
。
2022年には間葉系幹細胞もEPAを取り込みやすい可能性があることを見出しました。この結果はAAAモデル動物とヒトAAA壁で共通でした。間葉系幹細胞は炎症抑制や組織修復に関与する細胞です。
これらの解析から、食事として摂取したEPAは細胞にまんべんなく取り込まれることで全身の細胞の炎症性を低下させるのではなく、抗炎症や組織修復を担う細胞に選択的に取り込まれることによって、抗炎症・組織修復力を上げることで、疾患抑制機能をもつ可能性が示されました。
EPAの選択的な細胞への取り込みはどこでどのように起こるのでしょうか?これに対するアイデアはありますが、まだ検証できていないので、興味深い検討課題として今後の研究テーマとしたい考えております。
ご興味を持っていただいた方、一緒に研究しませんか?
現在は、AAAの病態形成を明らかにするための基礎研究のほか、薬剤や様々な食品機能性成分によるAAA予防・治療法の確立などを目標とした研究を行っています。本研究室では、これらの研究に共に取り組んでくれる方々を求めております。モデル動物の作出には本研究室の学生さんも関与しており、共同著者として名を連ねています。血管壁への脂肪細胞出現を伴うAAAの破裂というヒトのAAA破裂病態を再現できるモデルは存在せず、今のところ、本研究室で作出したモデル(循環不全誘導型AAAモデル)が世界で唯一のモデルとなります。これまでに確立されたいくつかのAAAモデルは、ヒトAAA病態の多くを明らかにしてきましたが、「なぜ血管が破裂するのか」という問題に対しては不明な点が多く残されています。循環不全誘導型AAAモデルが破裂機構の解明や、AAA破裂予防・治療法の確立に重要な役割を担うと期待しております。
AAAという疾患には不明な点が非常に多く、解明したいことがたくさんあります。興味を持たれた学生さん、共同研究を希望される企業や大学の方はぜひご連絡ください。(財満
zaimanobuhiro (a) gmail.com メール送信の際にはaを@に変えて下さい)(文責: 久後、財満)
これまでに発表した本研究室のAAA関連論文の主な内容
●原著論文
田中、財満ら PLoS One (2013)
・・・ヒトAAA血管壁では栄養血管の閉塞を起点とする循環不全が生じている。
田中、財満ら J. Vasc. Res (2015)
・・・ヒトAAA血管壁の外膜では脂肪細胞が異常出現する。
田中、財満ら PLoS One (2015)
・・・血管壁の循環不全はAAA形成・破裂の原因となることを人工的に循環不全を誘導した動物モデルで証明(循環不全誘導モデルの作出 hypoperfusion-induced
model)。本モデルは、ヒトAAAの基本的な病理像を再現できるほか、血管壁に脂肪細胞が出現するというAAA病理像を再現する世界で唯一のAAAモデルです。
※本論文は同年に掲載された論文のうち、引用数上位10%に入りました!
久後ら Biosci. Biotech. Biochem. (2016)
・・・循環不全誘導前からのEPAリッチな魚油の投与は、循環不全誘導モデルで形成されるAAAの進展を抑制する。
久後、財満、田中ら Sci. Rep. (2016)
・・・血管壁に異常出現する脂肪細胞が循環不全誘導モデルに形成されるAAAの破裂を誘導しうる。ヒト外膜に出現するTG(脂肪細胞)量とAAA径が相関する。EPAリッチな魚油の投与は、AAA血管壁の脂肪細胞量を減少させると同時にAAAの破裂を抑制する。
※この論文は、Springer Natureの編集部が選ぶ「おすすめのコンテンツ」に選ばれました!
久後ら Biotech. & Histochem. (2017)
・・・ニコチンは血管壁の膠原線維と弾性線維の破壊を誘導する。
久後ら Food & Funct. (2017)
・・・ニコチンによる弾性線維の破壊は、EPAリッチな魚油の投与によって抑制される。
久後ら J. Oleo Sci. (2017)
・・・循環不全誘導モデル動物で形成されたAAA破裂部位を観察し、破裂部位にそって脂肪細胞が存在していることを報告。脂肪細胞のある部位の血管強度が著しく低下していることを示唆。
※15 th J. Oleo Sci. Impact Awardを受賞しました!この賞は同年同雑誌に掲載された論文の中で引用数が最も多かった論文に与えられる賞です(引用数22
2020年12月17日現在)
橋本ら J. Vasc. Res. (2018)
・・・高脂肪食の摂取は循環不全誘導モデルに形成されるAAAの破裂を有意に上昇させる。AAA患者は高脂肪食の摂取は控えた方が良いかもしれない。
宮本ら J. Oleo Sci. (2018)
・・・
橋本ら J. Nutr. Sci. Vitaminol. (2018)
・・・ニコチンによる弾性線維の破壊は、食餌性のDNAの投与によって抑制される。
久後ら J. Oleo Sci. (2018)
・・・胸部大動脈瘤(TAA)壁でも脂肪細胞が増加していることを観察。脂肪細胞は、TAAの進展・破裂にも関与している「かも」しれない。 解析検体数が7例と少ないため、さらなる検討が必要。
久後ら J. Oleo Sci. (2019)
・・・ニコチンによる膠原線維・弾性線維の破壊は、セサミン・セサモリン高含有ゴマ抽出物によって抑制される。
久後ら Adipocyte (2019)
・・・AAA血管壁における脂肪細胞出現メカニズムを調べたところ、血管壁の循環不全により血管壁内で増加した間葉系幹細胞が、異所的に脂肪細胞に分化する可能性を示した。この間葉系幹細胞の由来の一つとして、血管周囲脂肪組織(PVAT)が考えられる。
※同雑誌過去5年間で最も引用された論文の一つに選ばれました!
Sukketsiriら J. Oleo Sci. (2019)
・・・イソフラボンはニコチンによる弾性線維の破壊を抑制する。
宮本、久後ら Sci. Rep. (2019)
・・・卵巣摘出したAAAモデルラットにおいて、血管線維成分の変性・減少が関与して発症率および瘤径が上昇する。女性のAAAは男性よりも成長が速く、瘤が破裂しやすい。これは加齢と共に卵巣機能が低下し、血管脆弱性が高まることによるものと考えられる。
星野ら J. Nutr. Sci. Vitaminol. (2020)
・・・黒大豆種皮抽出物はニコチンによる弾性線維の破壊を抑制す
久後ら Biology (2021)
・・・循環不全誘導のAAA血管壁において、AAA関連因子を経時的に病理観察した。
藤嶋ら Food & Funct. (2021)
・・・循環不全誘導のAAA血管壁において、EPAはM2マクロファージ(抗炎症作用を有する)と同様の局在を示した。
久後、Sukketsiriら Adipocyte (2021)
・・・低栄養が脂肪細胞に及ぼす影響を3T3-L1脂肪細胞を用いて評価した。循環不全により低栄養状態に陥った血管壁内では、脂肪細胞は炎症を誘導しAAA進展を促進する可能性がある。
中村ら J. Oleo Sci. (2021)
・・・卵巣摘出したラットにおいて、血管周囲組織(PVAT)の悪性化とそれに伴う血管線維成分の破壊が促進される。
佐宗ら Adipocyte (2021)
・・・高脂肪食がモデル動物に形成されるAAAの進展を促進する一方で、高シュークロース食はAAAの進展に影響を与えない理由が血管周囲脂肪にある可能性を示した。
宮本ら J. Oleo Sci. (2022)
・・・イソフラボンは卵巣摘出誘導性の大動脈変性に抑制する可能性を示した。
久後ら J. Lipid Res. (2022)
・・・AAA壁におけるEPAとM2マクロファージの共局在はヒトでも起こりうることを示し、EPAの抗炎症性が発揮される作用機序に、細胞への選択的な取り込みが関わる可能性を提示した。
久後ら Food & Function (2022)
・・・食事として摂取したEPAが動脈壁の間葉系幹細胞(MSC)に取り込まれうることを動物とヒト試料を用いて示した。
※HOT Article 2022に選ばれました!
岸・東原ら Biomedicine & Pharmacotherapy.(2022)
・・・吸入したβカリオフィレンの血管保護作用を示した。
久後ら J. Oleo Sci. (2023)
・・・腹部大動脈瘤患者の食事調査。浜松医大の方々に多大なるご協力をいただきアンケートを集めるだけで2年かかりました。
山田ら Experimental and Therapeutic Medicine. (2023)
・・・βカリオフィレンのヒト試験。この論文をもとに腹部大動脈瘤の予防剤ができることをつよく期待。
久後ら Biomedicine & Pharmacotherapy.(2022)
・・・AAAに対するトリカプリンの治療効果の可能性を示した。この論文が腹部大動脈瘤治療薬の創出につながることをつよく期待 ※ 2024年5月から大阪大学医学部附属病院にて特定臨床研究が開始されました!
東原ら PharmaNutrition (2023)
・・・閉経モデルで誘導される血管変性に対して核酸とコラーゲンの混合物が抑制的にはたらく可能性を示した。
久後ら Biotechnic & Histochemistry (2024)
・・・ニコチンが栄養血管狭窄を誘導しうることを示した。
須見ら Food Sci. Technol. Res. (2024)
・・・高スクロース食、高グルコース食、高フルクトース食が胸部大動脈に及ぼす影響を比較し、高フルクトースの悪影響が最も強いことを示した。
Wanidaら Adv. Pharmacol. Pharm. Sci. (2024)
・・・カプリン酸とカプリル酸は、血管平滑筋細胞においてツニカマイシン誘導性の小胞体ストレスを軽減することを示した。
樺ら CJC Open (2024)
・・・トリカプリン(カプリンHI🄬)を用いて世界初の腹部大動脈瘤治療薬創出を目指したヒト臨床試験のプロトコールペーパー。最初の一歩であり、この試験だけで全てが解決するわけではありませんが、これからの発展につながることを強く期待
東原、清水ら Fitoterapia (2025)
・・・ニコチン誘導性血管変性に対する保護効果がターメロンのかおりにあることを示した。
●総説など
財満 J. Atheroscler. Thromb. (2017)
・・・n-3PUFAの摂取とAAA進展について
久後ら Curr. Drug. Targets (2018)
・・・脂肪細胞とAAAの関係
久後ら Ann. Vasc. Dis. (2018)
・・・脂肪細胞とAAAの関係
宮本ら 近畿大学農学部紀要 (2019)
・・・AAA進展・破裂と食生活の関わり
財満ら 食品と開発 (2020)
・・・AAAに対するn-3系高度不飽和脂肪酸の効果
須見ら Biosci. Biotech. Biochem. (2024)
・・・食品とAAAの関わり
