
研究内容
植物の免疫機構の概要
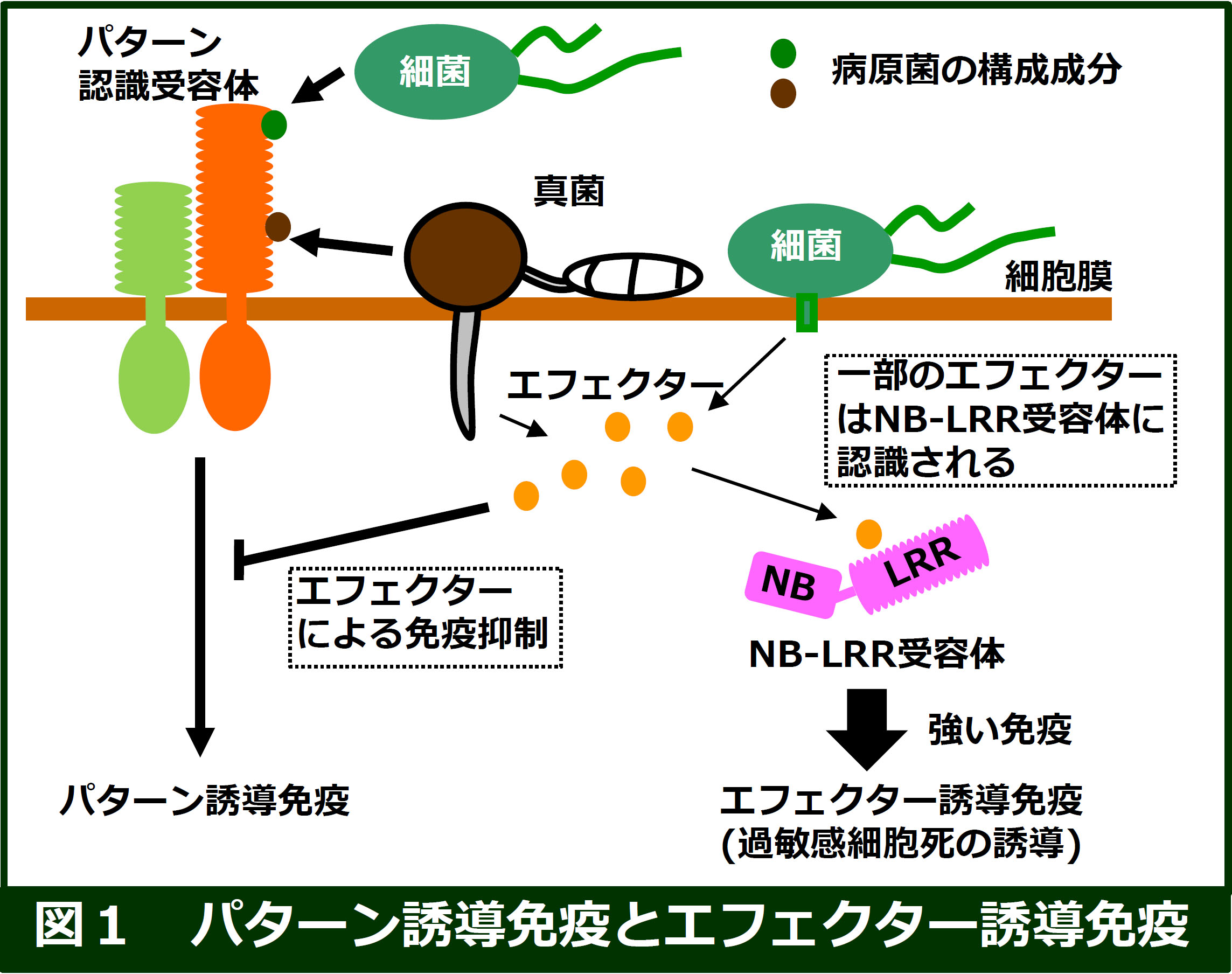
植物は、病原菌認識受容体(病原菌認識センサー) をもち、病原菌の感染を検出して迅速な防御応答を誘導します。このような受容体を介した防御反応の誘導機構は、 動物の先天性自然免疫と非常によく似ているため、「植物免疫 (Plant Immunity)」と呼ばれています。
病原菌認識受容体は、構造的特徴から大きく2種類、細胞膜に局在型する受容体と細胞内に存在するNB-LRR型受容体(詳細は後述)に分けられます(図1)。
細胞膜に存在する受容体は、パターン認識受容体(Pattern Recognition Receptor (PRR))と呼ばれ、細胞外に病原菌/微生物の構成成分(PAMP/MAMP:
Pathogen/Microbe-Associated Molecular Pattern)を検出するドメインをもちます。パターン認識受容体の細胞外ドメインとしては、LRR
(leucine-rich repeat)やLysM (lysin-rich motif)などが知られています。さらに、パターン認識受容体の細胞内ドメインにプロティンキナーゼドメインを持つものは、Receptor-like
kinase(RLK:受容体型キナーゼ)と呼ばれ 、持たないものは、Receptor-like protein (RLP:受容体型タンパク質)と呼ばれています。パターン認識受容体がPAMPs/MAMPsを検出すると、多種多様な免疫反応が誘導されますが、それはパターン誘導免疫
(Pattern-triggered immunity)と呼ばれています。。 病原菌のPAMPsとしては、細菌のべん毛タンパク質やペプチドグリカン、真菌のキチンがよく研究されています。
一方、病原菌は、植物の細胞内にエフェクターと総称されるタンパク質を分泌します。エフェクターは、パターン認識受容体など、主要な免疫因子の活性を阻害することで、パターン誘導免疫を阻害することが知られています。図1では、一部の細菌がエフェクターを分泌するために使用する Type III分泌システムを示していますが、 病原菌(細菌、真菌、卵菌など)の種類によって分泌システムは異なります。
耐病性育種では、古くから、病原体に対して強い抵抗性を誘導する病害抵抗性遺伝子座が広く利用されてきました。この病害抵抗性遺伝子座がコードするタンパク質の多くは、NB-LRR受容体であり、1,990年代中頃から、病害抵抗性遺伝子として、多数のNB-LRR受容体が同定されています。ここ20年の研究により、NB-LRR受容体は、病原菌エフェクターを認識し、強い免疫反応を誘導する受容体であることが明らかになってきました(エフェクター誘導免疫)。また、植物は非常に多くのNB-LRR遺伝子を持つことから(イネは500遺伝子)、NB-LRR型受容体が病害抵抗性の獲得において中心的な役割を果たしてきたと考えられます。NB-LRR受容体は、核酸結合部位(NB: Nucleotide Binding)とロイシンの繰り返し配列をもつ部位(LRR: Leucine-rich repeats)から構成されています。また、N末端領域にコイルドコイルドメインやTIRドメインをもち、それらはNB-LRR受容体の機能において重要な働きをしています。動物では、NBドメインはNod (Nucleotide oligomerization domain)と呼ばれていますが、近年では、NLR (NB:NOD-like receptor)と総称されることが 多くなりました。
パターン認識受容体によるPAMP認識やNB-LRR受容体によるエフェクター認識に伴って、様々な防御反応が誘導されます。 これらの防御反応を誘導する信号伝達において、MAPキナーゼカスケード(MAPKKK、MAPKK、MAPKの3つのリン酸化酵素から成る信号伝達経路) が主要な役割を果たしています(図2)。MAPKは、様々な転写因子をリン酸化することで、免疫に関わる多くの遺伝子の発現を制御していることが知られています。当研究室では、このような免疫誘導機構について研究を進めています。
研究内容
1)植物のパターン誘導免疫の分子機構の解明

細胞膜上に存在するパターン認識受容体(PRR)は、PAMPsを認識して細胞内に防御反応を誘導することが知られていますが、そのメカニズムは十分に理解されていません。
我々は、真菌のPAMPであるキチンや病原細菌のPAMPであるペプチドグリカン(PGN)の認識によって誘導される免疫系をモデルとして研究を進めています。これまでに、
イネでは、キチンと結合する受容体型タンパク質であるCEBiPと、PGNを認識する受容体型タンパク質であるLYP4/LYP6が同定されています。これらの受容体型タンパク質がキチン/PGNを認識すると、
受容体型キナーゼであるOsCERK1と複合体を形成し、それが引き金となって細胞内に防御反応が誘導されることが知られています。我々は、これまでにReceptor-like
cytoplasmic kinase (RLCK)ファミリーに属するOsRLCK185を単離し、OsRLCK185がOsCERK1によって直接活性化され、OsRLCK185がMAPキナーゼカスケードを活性化することで様々な免疫反応を誘導することを明らかにしました(図2;
Cell Host & Microbe (2013), Plant Cell Physiol (2017))。さらに、OsRLCK185のシロイヌナズナホモログとして単離したPBL27もMAPキナーゼカスケードを活性化することが分かり、RLCKファミリーがパターン認識受容体とMAPキナーゼカスケードを結ぶ分子であることを明らかにしました(EMBO
J (2016))。
また、我々はパターン誘導免疫に関わるユビキチンリガーゼPUB44を同定しました (Nature Commun (2014))。さらに、OsPUB44と相互作用する因子としてPBI1を発見しました。病原菌の非感染時では、PBI1は、イネの免疫の鍵因子であるWRKY45を抑制していますが、病原菌感染に伴い、パターン認識受容体を介してPUB44がリン酸化されると、PUB44が活性化し、PUB44がPBI1をユビキチン化・分解することで、WRKY45に依存した免疫が誘導されることを解明しました(Nature Commun (2022))。
2) 病原菌エフェクターによる感染戦略の分子機構の解明
病原菌は、エフェクターと総称されるタンパク質を植物の細胞内に送り込み、様々な植物免疫因子を阻害することで、免疫応答を阻害しています。つまり、
エフェクターは、病害を引き起こす最強の病原性因子であると言えます。そのため、当研究室では、病原菌エフェクターが、どのように植物細胞内で働いているかを研究しています。さらに、このような病原菌の感染戦略を理解することで、新規な病害防除法の開発を目指しています。。
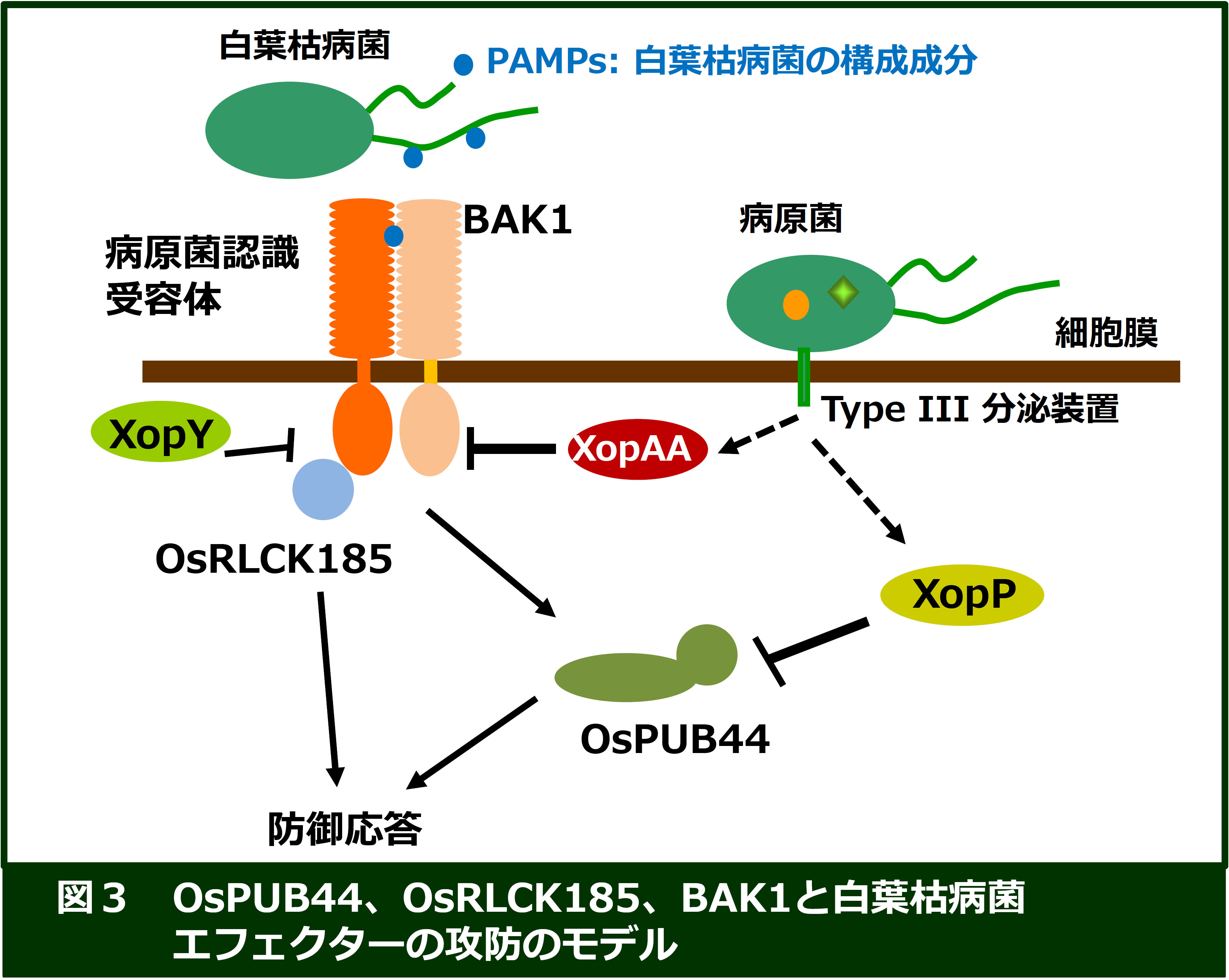
これまでに、我々は、イネの白葉枯病菌のエフェクターXopY (Xoo1488)が標的としているイネ因子を探索し、OsRLCK185を単離しました
(図3)。解析の結果、XopYは、CERK1によるOsRLCK185のリン酸化を阻害することが明らかになりました (Yamaguchi et
al. Cell Host Microbe 2013)。さらに、イネの白葉枯病菌のエフェクターXopP(Xoo3222)を解析し 、相互作用因子としてPUB44を同定しました。PUB44は、U-boxドメインをもつユビキチンE3リガーゼであり、
免疫応答のポジティブレギュレーターとして機能していることがわかりました。さらに、XopPはPUB44のU-boxに結合することで、 リガーゼ活性を阻害し、免疫応答を抑制していることが明らかになりました(Nature
Commun (2014))。現在、白葉枯病菌の機能未知なエフェクターに関して、標的因子を同定し、その機能解析を進めています。
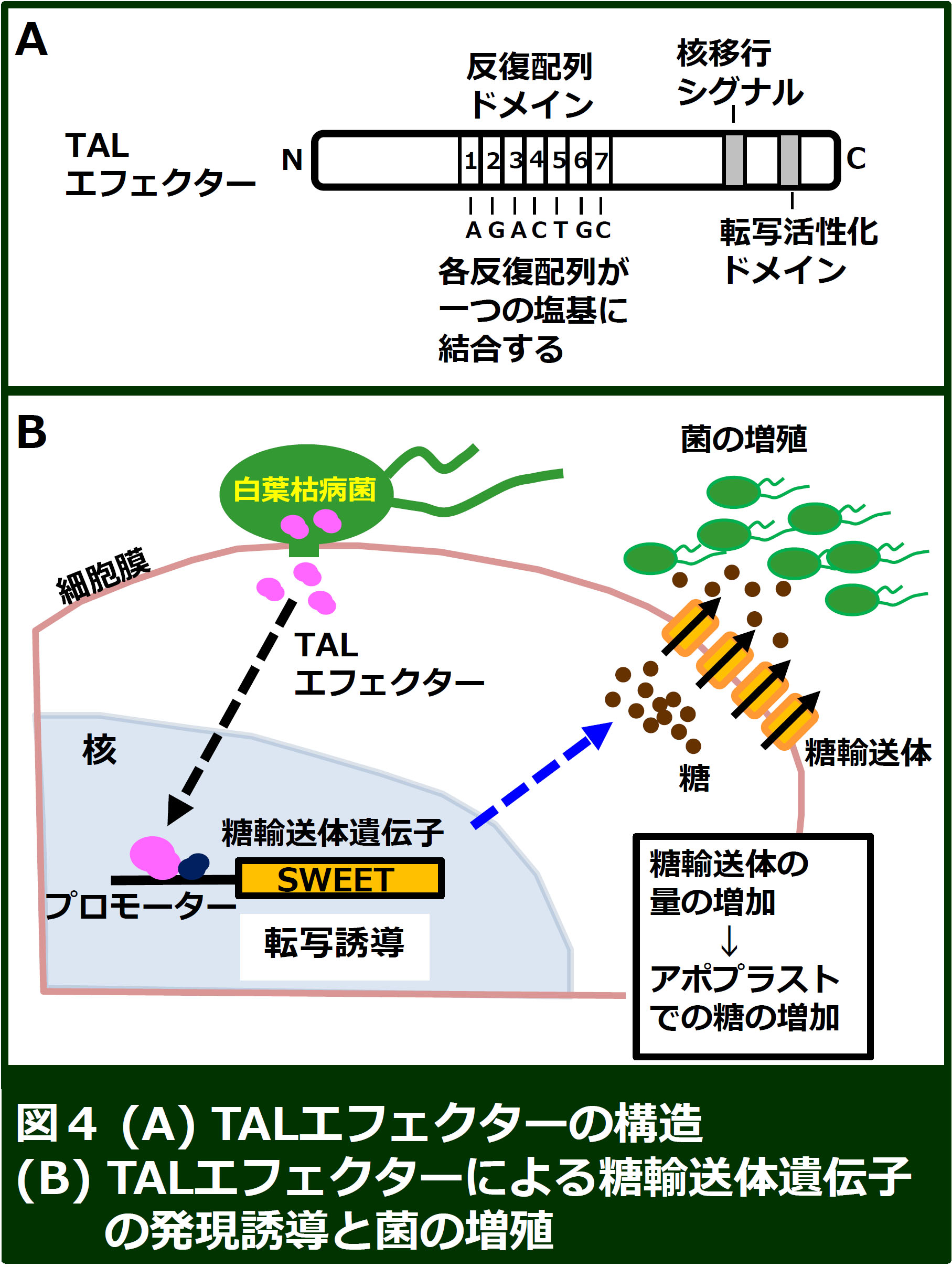 また、白葉枯病菌がもつTAL(Transcription Activator-Like)エフェクターは、反復配列により構成される特殊なDNA結合ドメインをもち(図4A)、植物の核に移行して、転写因子として働くことが知られています。このDNA結合ドメインの利用により、任意の塩基配列に結合するタンパク質が人工的に構築できるため、ゲノム編集技術として広く利用されています(TALEN技術)。白葉枯病菌のTALエフェクターはイネの糖輸送体遺伝子(SWEETと呼ばれる)のプロモーター領域に結合し、転写を促進することで、細胞膜に存在する糖輸送体の量を増加させることが知られています。このような糖輸送体の増加は、細胞内からアポプラストに放出される糖の量を増加させ、それを栄養源とする細菌の増殖に有利に働くと考えられています(図4B)。当研究室では、TALエフェクターがどのように植物の転写制御システムをハイジャックしているのかを明らかにするため、研究を進めています。
また、白葉枯病菌がもつTAL(Transcription Activator-Like)エフェクターは、反復配列により構成される特殊なDNA結合ドメインをもち(図4A)、植物の核に移行して、転写因子として働くことが知られています。このDNA結合ドメインの利用により、任意の塩基配列に結合するタンパク質が人工的に構築できるため、ゲノム編集技術として広く利用されています(TALEN技術)。白葉枯病菌のTALエフェクターはイネの糖輸送体遺伝子(SWEETと呼ばれる)のプロモーター領域に結合し、転写を促進することで、細胞膜に存在する糖輸送体の量を増加させることが知られています。このような糖輸送体の増加は、細胞内からアポプラストに放出される糖の量を増加させ、それを栄養源とする細菌の増殖に有利に働くと考えられています(図4B)。当研究室では、TALエフェクターがどのように植物の転写制御システムをハイジャックしているのかを明らかにするため、研究を進めています。
3)植物のエフェクター誘導免疫の分子機構の解明
NB-LRR受容体は、細菌、真菌、ウイルス、ウンカ、線虫、アブラムシ、ヨコバイなど様々な病害虫を認識して、強い免疫反応を誘導するため、古くから耐病性育種に利用されてきました。しかし、長い間、NB-LRR受容体がどのように免疫反応を誘導しているかについて不明でした。近年、クライオ電顕を用いた研究により、NB-LRR受容体がレジストゾームと呼ばれる複合体が形成するなど、新たな知見が得られつつありますが、現状では、NB-LRR受容体による免疫の活性化メカニズムに関しては殆ど理解されていません。。
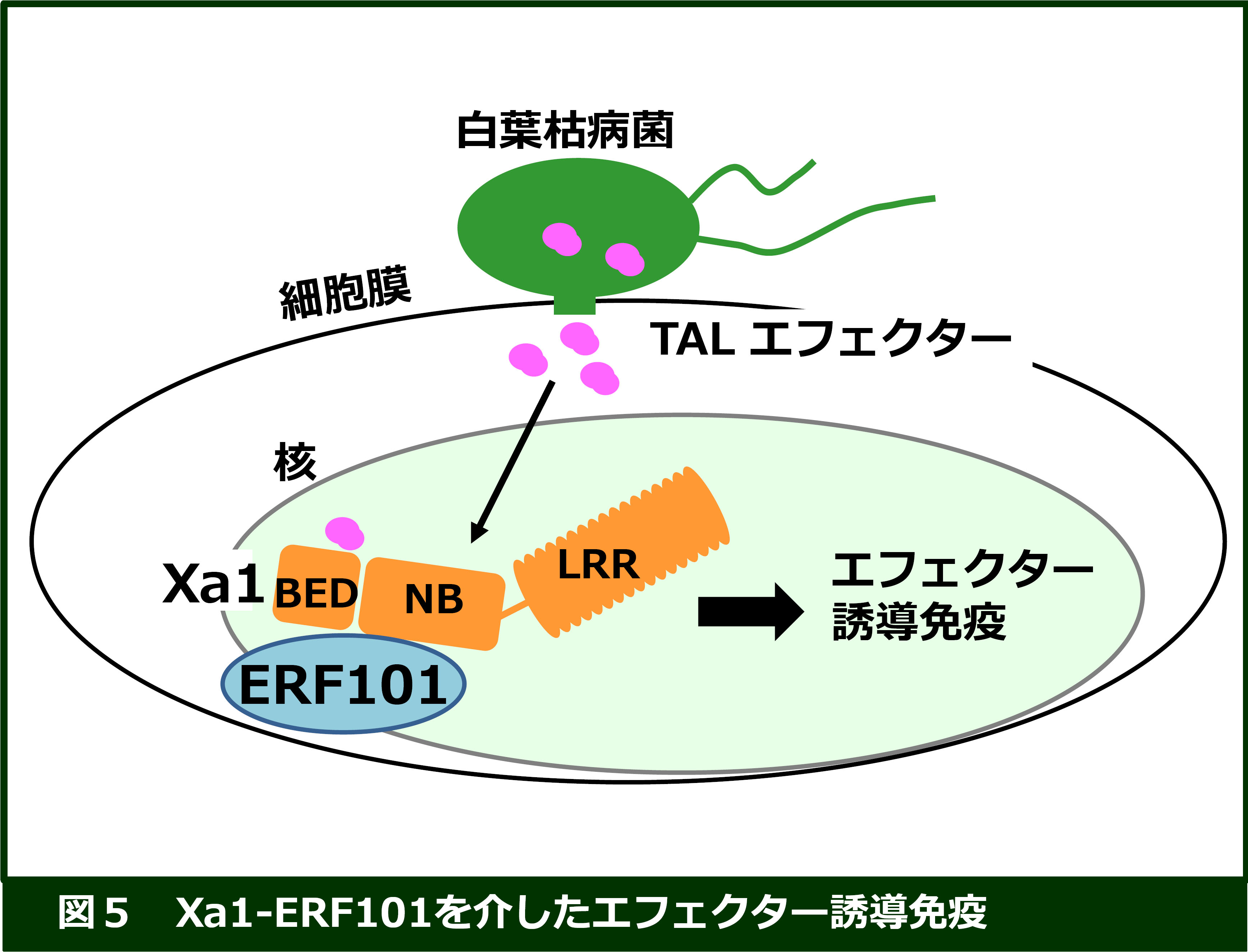
イネ白葉枯病菌の抵抗性遺伝子Xa1は、NB-LRR型受容体です (Yoshimura et al. PNAS 1998)。Xa1は、上述の白葉枯病菌のTALエフェクターを認識することで強い免疫反応を誘導すると考えられていますが、その分子メカニズムは不明です。当研究室では、Xa1に相互作用する因子として、AP2/ERF型転写因子ERF101を同定し、ERF101がXa1誘導免疫におけるポジティブレギュレーターとして働いていることを明らかにしました(Yoshihisa
et al. New Phytol (2022))。現在、Xa1・ERF101複合体が、どのようにTALエフェクターを認識し、どのように免疫を活性化しているかについて研究を進めています。
4)植物免疫におけシグナル伝達機構の解析
植物免疫の初期応答において、MAPキナーゼ(MAPK)カスケードの活性化、活性酸素の生成、カルシウムの一過的上昇が生じ、それに引き続いて様々な免疫応答が活性化されることが知られていますが、その制御メカニズムはあまり理解されていません。。これまでに、我々は、OsRLCK185やPBL27などのRLCKファミリーが、パターン認識受容体からMAPKカスケードの活性化に至る信号伝達を明らかにしました(EMBO J (2016)。現在、白葉枯病菌の標的となっているイネの信号伝達因子に関して、様々な解析を進めて、イネの免疫シグナル伝達機構の解明を目指しています。
5)植物の成長を制御する共生菌の研究
植物体内や土壌中には多くの微生物が存在し、共生菌として植物の成長や免疫を支えています。共生菌の代表例として、根粒菌や菌根菌がよく知られています。イネでは、菌根菌の感染がOsCERK1を介して制御されていることが知られており、その制御メカニズムの解析を進めています。さらに、新たに、植物の成長を促進する共生菌を探索・同定し、それらの機能解析を進めています。
6)環境にやさしい耐病性技術の開発
免疫反応において、抗菌性物質の蓄積、活性酸素生成、カロースの形成、病原菌を分解する酵素の発現など、 様々な防御システムが活性化されますが、それらの始点となるのは病原菌認識です。我々は、病原菌認識機構およびそれに 続く信号伝達機構の基礎研究およびその理解を通して、このような多面的な防御反応を協調的に誘導できる耐病性技術の構築を 目指しています。近年、シロイヌナズナやイネで得られた遺伝子あるいは情報を、他の植物・作物に応用する 「Translational Research」が実現していますが、 我々の研究成果が応用技術として、食料生産やエネルギー生産に貢献できることを期待しています。
